全球首个长效IL-4Rα单抗MG-K10中重度特应性皮炎适应症上市申请获受理
2025-10-31 0
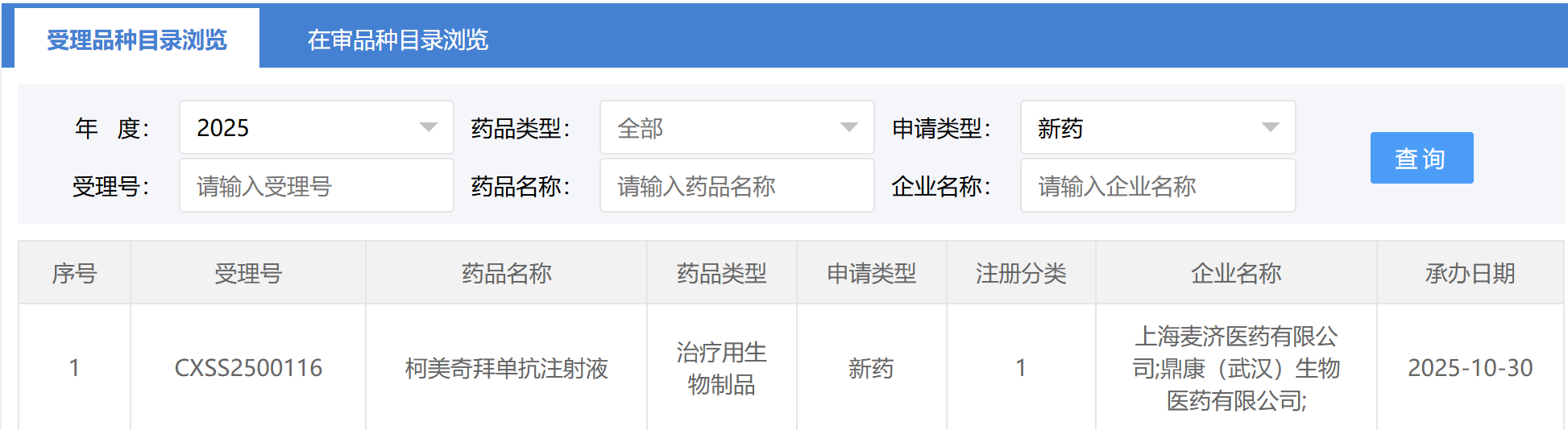
2025年10月30日,由麦济生物提交的1类创新药柯美奇拜单抗注射液(研发代号:MG-K10)的中国上市许可申请获得中国国家药品监督管理局(NMPA)受理,受理号为CXSS2500116,产品拟用于治疗成人中重度特应性皮炎。
MG-K10
MG-K10是由麦济生物自主研发的创新长效抗IL-4Rα人源化单抗,能同时阻断关键2型炎症因子IL-4和IL-13的信号传导。凭借更长的半衰期,产品可实现300mg每四周一次的给药频率(已上市抗IL-4Rα药物均为300mg每两周一次给药频率),提升患者依从性,并有望成为全球首个上市的长效抗IL-4Rα单抗,具有成为同类最优(Best-in-Class)的潜力。MG-K10已在成人中重度AD的一项随机、双盲、安慰剂对照III期临床研究取得阳性结果,达到方案设计的临床试验主要研究终点,且MG-K10 300mg每四周一次治疗第52周时,研究者整体评估(IGA)评分达到0或1分,且较基线改善≥2分的受试者比例为 76.6%;达到湿疹面积及严重程度指数评分较基线至少改善75%(EASI 75)的受试者比例为94.3%;达到湿疹面积及严重程度指数评分较基线至少改善90%(EASI 90)的受试者比例为79.1%。安全性方面,52周治疗期不良事件(TEAE)大多数为1-2级,且同靶点药物常见的不良反应(结膜炎、注射部位反应等)MG-K10发生率较低。MG-K10哮喘、结节性痒疹和季节性过敏性鼻炎均已进入III期临床试验阶段。
麦济生物
麦济生物成立于2016年,始终秉承“创新、高效、安全”的研发理念,专注于过敏性炎症疾病和自身免疫性疾病等领域。麦济生物拥有一支由行业顶尖专家组成的研发团队,凭借卓越的研发能力和深厚的行业积淀,利用特有的TEADA高通量抗体筛选平台,开发高生物学活性、高成药性、差异化的创新抗体药物,致力于为全球患者带来更加安全、有效、便捷的治疗方案。除MG-K10外,麦济生物的TSLP单抗(半衰期超过80天)已进入哮喘II期临床试验,同时半衰期延长改造的MASP-2单抗已获得IND批件。
